
CBL-514 注射劑
CBL-514市場價值
1,146億美元2030年全球局部減脂
與身體塑形醫美市場預估
2030年全球竇根氏症市場預估
199億美元2030年全球橘皮治療市場預估
55億美元- 全球首創減脂技術,能誘導脂肪細胞凋亡,不會造成其他組織、細胞壞死或損傷
- 全球唯一可使用於腹部、大腿等大範圍部位的局部溶脂注射劑
- 藥品安全性與耐受度良好,副作用低,無後遺症或系統性副作用及風險
- 效果顯著,治療一次即可顯著減少治療部位皮下脂肪
- 治療後平均可減少312.1 ml局部脂肪,療效優於抽脂手術與其他非手術局部減脂產品
適應症
- 非手術局部減脂 Non-Surgical Fat Reduction
- 罕見疾病-竇根氏症 Dercum’s Disease
- 橘皮組織 Cellulite
階段
非手術局部減脂
市場概況
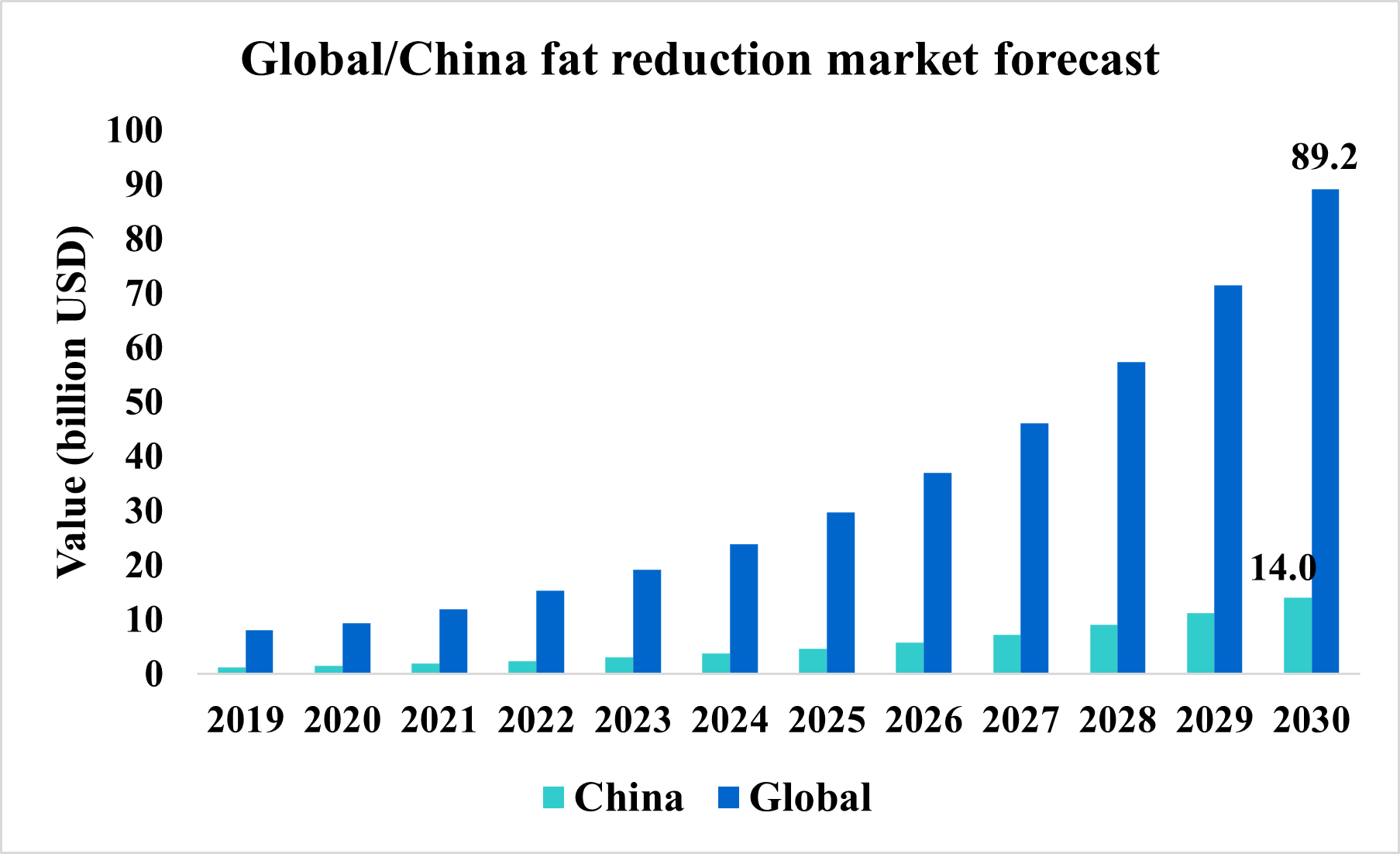
根據Deloitte China Aesthetic Medicine Market Outlook Report與 Deloitte中國身體塑形市場行業發展白皮書報告指出,2019年全球的醫美藥物(Aesthetic medicine)的市場為 1,459億美元,中國市場為 1,769億 RMB(相當於 229.06億美元),2019年中國市場佔全球約為 15.7%;中國在 2030年的身體塑形市場 (體雕 )將突破 1,000億 RMB(約為 140億美元),以中國市佔率 15.7%推算,預估 2030年全球市場將超過 892億美元 。
根據國際美容整形外科學會 (ISAPS) 2022 年的報告與GRAND VIEW RESEARCH的報告指出,北美是局部減脂的最大市場,其中又以美國為主要市場,2022年的市場占比約為 38.6%。
局部減脂簡介
根據ISAPS的2022年報告顯示,抽脂手術為全球最熱門的醫美手術,全球總施作率高達230萬次,相較於2021年成長21%。。
目前的局部減脂治療方式可分為侵入性的手術(包括抽脂手術與腹部成型手術)與非侵入性(非手術)的局部減脂設備或注射劑,其中侵入性的手術效果較佳,但手術風險高,且副作用與後遺症明顯、恢復期長,術後需要長達3~6個月修復期;非手術的局部減脂設備或注射劑雖降低了手術的副作用,但大多數產品仍有實施部位的限制,且治療效果不明顯,至少需要2-3次治療,12週以上才能看到療效,另外,目前非手術的局部減脂仍有一定程度的副作用與後遺症,包括治療部位異常脂肪增生、神經損傷與痲痹、治療部位組織壞死...等,療程費用也相當昂貴,導致許多想進行局部減脂的消費者因為不滿意目前的治療方式而裹足不前。根據美國整型醫學會年報ASPS研究指出,目前僅有不到40%的人尚可接受目前的局部減脂療程,超過60%的人因為不滿意現有的治療方式或害怕副作用與後遺症而卻步,因此,市場需求遲遲未能被滿足,實際的潛在市場更為龐大。由於愛美是人的天性,在追求完美體態的趨勢下,若能開發安全又有效的局部減脂方式,將會大幅增加消費者使用意願並拓展新的未被滿足的身體雕塑市場,正式引領身體塑形進入醫美微整的時代,並創造更大的市場。
產品研發進展
CBL-514 注射劑是505(b)(1)的小分子新藥,是全球首創能誘導脂肪細胞凋亡來減少注射部位局部脂肪,精準減少治療部位的脂肪,且不會造成其他組織細胞壞死或損傷,療效明顯優於現有非手術減脂產品,效果接近抽脂手術,並具有良好的藥品安全性與耐受度,CBL-514 以皮下脂肪注射方式給藥,不需進行外科抽脂手術,即可明顯減少局部皮下脂肪,達到雕塑曲線的目的。
CBL-514注射劑在醫美-非手術局部減脂適應症,已於2023年完成兩階段的 Phase 2 試驗,目前有一項 Phase 2b 臨床試驗正在美國與加拿大進行中。
根據 CBL-514 已完成的 2 stage- Phase 2 臨床試驗(CBL-0202 Phase 2)結果顯示,CBL-514的療效在 ITT population 與 PP population 分析皆達到臨床及統計上顯著有效意義;且與安慰劑組相比,均具有顯著統計差異(p< 0.00001)。CBL-514 治療後平均可減少至少 312.1 mL治療部位皮下脂肪,76.2%的受試者可減少至少200 mL治療部位皮下脂肪。整體藥品的安全性與耐受度良好,治療後無後遺症,不會造成注射部位細胞壞死。CBL-514可降低現有侵入性手術造成的手術風險、術後副作用與後遺症,並明顯縮短術後恢復期,產品減脂機轉新穎安全,符合醫美市場自然、安全、有效的三大趨勢,未來上市後將可望成為非手術局部減脂治療的領導產品。
罕見疾病-竇根氏症
市場概況
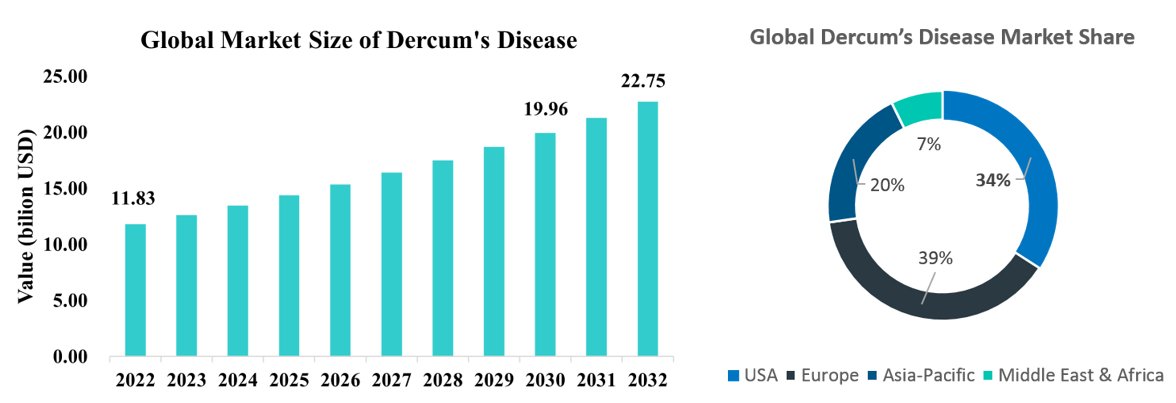
全球 2022 年竇根氏症(Dercum’s disease)市場約為 118.3 億美元(美國市場佔全球34%),以 CAGR 值 6.76% 推估 2032 年全球市場可達 227.5 億美元。
罕見疾病-竇根氏症簡介
竇根氏症為一種痛性脂肪瘤罕見病,病患軀幹及四肢會長有多顆皮下脂肪異常堆積的痛性脂肪瘤,並伴隨該部位自發性的嚴重疼痛,疼痛性質為陣發性、灼熱劇痛。據估計,目前美國約有12.5萬人罹患竇根氏症,在歐洲則約為24萬名病患深受此病所苦。竇根氏症目前尚未確定發病原因,研究指出很可能與神經系統功能障礙、神經組織受到機械性壓力、脂肪組織代謝障礙有關。
竇根氏症目前尚無治療藥物或產品核准上市,僅能以手術減少脂肪瘤大小、抽脂、麻醉或止痛藥等療法緩解疼痛症狀。然而,多數止痛劑僅能短暫緩解疼痛,成效不彰;而手術切除脂肪瘤或抽脂雖可透過縮小痛性脂肪瘤以減緩疼痛,但仍有術後傷口照護、手術副作用及後遺症等風險,且手術後常造成脂,甚至惡化的問題。
| 目前療法 | 手術切除/抽脂手術 | 麻醉/止痛藥 | 免疫調節劑 | |
| 目的 | 移除脂肪瘤/抽脂 | 緩解疼痛 | 緩解發炎 | 緩解疼痛 |
| 缺點 | 傷口多且深、無法根治、術後第一個月症狀惡化、容易復發 | 短暫緩解疼痛,無法根治,治療效果不佳 | 治療效果不佳、無法根治、副作用大,可能讓病況更嚴重,無法縮小脂肪瘤 | 短暫緩解疼痛、無法根治、療程長 無法縮小脂肪瘤 |
| 缺點及不良反應 | 疼痛、瘀青、感染、紅腫、硬塊、手術部位凹陷... 等 | 嚴重發燒、倦怠、頭痛、背痛及感染... 等 | 頭痛、疲倦、腹瀉、胃部不適、感染、超敏反應、骨髓抑制、肝毒性等 | 治療部位灼熱、發紅 |
產品研發進展
透過促脂肪細胞凋亡之機轉,CBL-514 注射劑能專一性地減少治療部位的脂肪,並抑制脂肪細胞分化成熟並與減少脂肪新生。在已完成的研究當中,也發現 CBL-514 能顯著促進脂肪瘤細胞進行細胞凋亡,因此,應具有治療竇根氏症的潛力。康霈目前已完成 CBL-514 應用於竇根氏症之 Phase 2 臨床試驗(CBL-0201DD),其結果顯示能顯著縮小或完全清除痛性脂肪瘤,並顯著改善疼痛症狀。CBL-514已於2024年2月取得美國 FDA授予快速審查認定 (Fast-Track Designation)資格與孤兒藥資格認證 (Orphan Drug Designation, ODD),是目前完一獲得雙資格認證之竇根氏症臨床藥物,將有助加速後續藥證申請與審查時程,未來有機會能治療竇根氏症並成為首選用藥,造福病人。
橘皮組織
市場概況
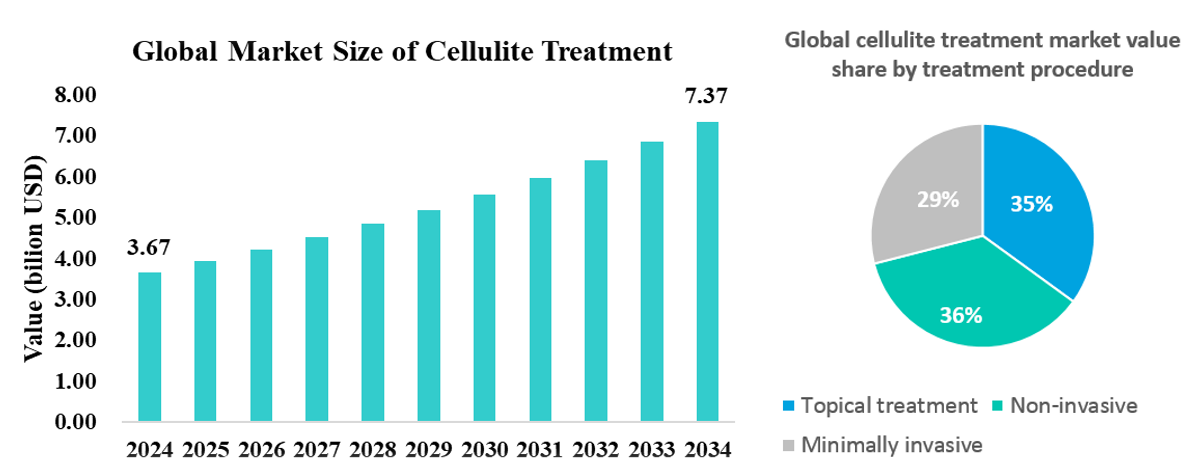
根據Future Market Insights報告指出,全球橘皮(Cellulite)治療市場規模在2024年約為36.7億美元,預估2032年市場將達73.7億美元。根據國外研究指出,青春期過後的女性當中,約有高達80-90%的比例有橘皮組織的困擾,且隨著年紀增長及肥胖程度,得到橘皮組織的機率將會愈來愈高。
橘皮組織簡介
橘皮組織為皮下淺層脂肪因為脂肪細胞數量過多或體積太大堆積並擠壓皮下纖維瓣突出到真皮,由於身體局部的皮膚脂肪厚度和彈性不同,導致皮膚表面像橘子表皮一般凹凸不平。常見症狀包括:皮下脂肪腫脹、皮膚下垂、表皮凸起有如橘子表皮般,因此稱之為橘皮組織。容易發生在臀部、大腿、腹部、腰部等處,且女性得到橘皮組織的機率遠高於男性。由於橘皮組織產生位置較淺,因此無法用抽脂手術改善,減輕體重、按摩或口服藥物的改善效果亦不佳。
目前治療橘皮組織的方式主要以非侵入性(醫療器材或注射劑)與侵入性(微創手術設備)為主,其中又以非侵入性治療佔市場最大份額。但是,無論侵入性或非侵入性的治療方式,大多只能''暫時改善''橘皮組織,且療效不佳,多數的療程其術後瘀青與副作用都相當明顯。
| 現有療法 | 非侵入性藥品 | 非侵入性設備 | 微創手術 | |
| 美國FDA核准適應症 | 治療中-重度橘皮組織 | 短期改善橘皮外觀 | 短期改善橘皮外觀 | 長期改善橘皮外觀 |
| 療效 | 治療後10週,僅6-8%受試者改善2個等級 | 治療1次後12週,橘皮外觀改善 | 治療1次後1年,皮膚厚度增加25%,皮膚彈性增加29% | 治療1次後效果可持續2年 |
| 副作用與不良反應 | 嚴重過敏反應、瘀傷、疼痛、搔癢、結節、變色、腫脹、免疫原性(Immunogenicity) | 疼痛、治療部位可接受的副作用 | 傷口照護需1~2週、發紅、疼痛、腫脹、瘀傷、搔癢、起泡、壞死 | 傷口照護需1~2週、腫脹、壓痛、瘀傷 |
產品研發進展
由於造成橘皮組織的主要成因為淺層皮下脂肪細胞過多擠壓皮下纖維隔膜(fibrous septae)造成皮膚凹凸不平的外觀,CBL-514能精準減少局部的皮下脂肪,可透過注射減少淺層脂肪來改善橘皮組織,而且不會有目前局部減脂療程術後的纖維化疤痕組織或硬塊,瘀青或治療部位的副作用也較不明顯,預估將能更安全有效地治療橘皮組織。CBL-514注射劑在橘皮組織適應症,已於2024年4月取得2階段 Phase 2臨床試驗最終臨床統計結果,其試驗主要與次要療效指標皆達臨床及統計上顯著意義,且藥物安全性與耐受度良好;超過50%的受試者治療後12 周橘皮組織嚴重程度可達到至少一個等級的改善,高達95%以上受試者之大腿橘皮組織有改善。


